Kanser Karşı Truva Atı: Peptid Nanotüpler, İlaç Dirençli Tümörleri Bile Yok Edebiliyor
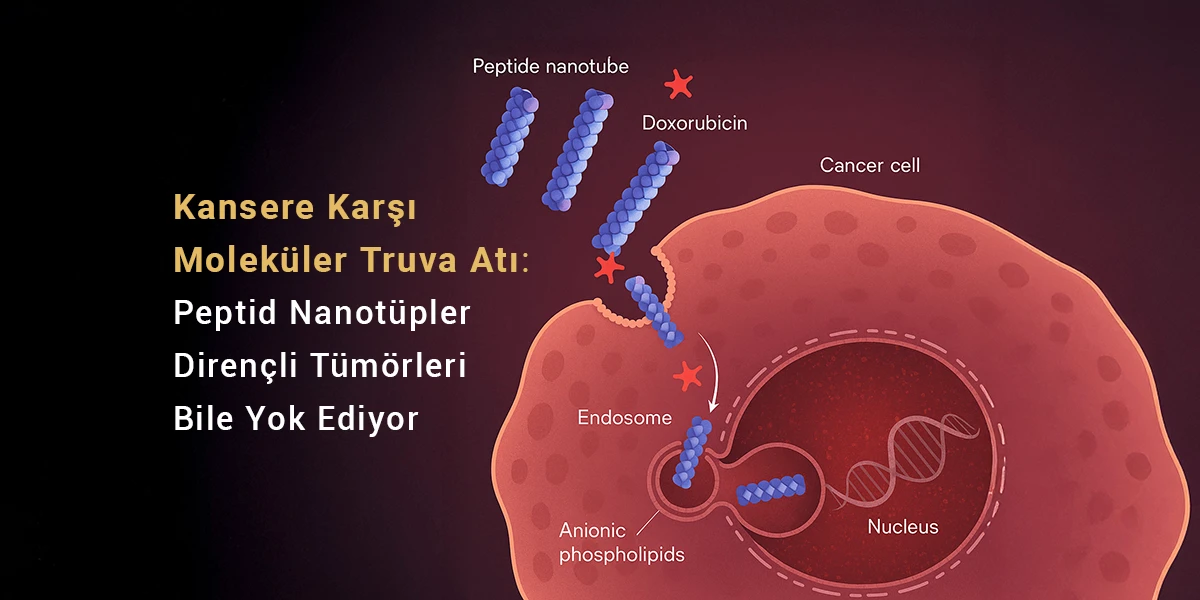
ACS Applied M&I dergisinde yayımlanan çalışmanın sonuçlarına göre, yeni geliştirilen peptid nanotüpler ile dirençli tümör hücrelerini yok etmek mümkün olacak. Moleküler düzeyde tasarlanan bu nanotüplerin içine gizlenen ilaçlar doğrudan kanserli hücrelerin çekirdeğine ulaşarak DNA’sını tahrip edebiliyor. Bir Truva Atı gibi davran bu nano-kapsüller, pozitif yükleri sayesinde tümörlü hücreleri yüzeylerindeki negatif yüklü fosfolipit moleküllerinden tanıyarak doğrudan bağlanabiliyor. Bu özellikleri onları çok etkili bir tedavi ajanı haline getiriyor; üstelik bu tedavinin hiç bir yan etkisi bulunmuyor.
Bilim insanları, doxorubisini adlı kemoterapi ilacını doğrudan dirençli kanser hücrelerinin çekirdeğine taşıyan ve kanserli hücre zarına yapışabilen peptid nanotüpler geliştirdi. Bu yenilikçi sistem, kemoterapi gibi güçlü bir silahı daha etkili hale getiriyor. Üstelik, tümör zarlarını seçici biçimde hedef aldığı için sağlıklı hücreler bu ölümcül silahtan etkilenmiyor.
Kanser Tedavisinde Direncin Üstesinden Gelmek
İlaç direnci, onkolojide en inatçı engellerden biri olmaya devam ediyor. Pek çok hastada zamanla kemoterapiye karşı direnç geliştiği için doktorların çoğu zaman seçeneksiz kalıyor. Ancak Santiago de Compostela Üniversitesi’nden (CiQUS) bilim insanları, bu sorunu tersine çevirecek moleküler bir yöntem geliştirdi: Antikanser ilaçların hücre içine giriş ve etki biçimini tamamen yeniden tasarladılar.
Araştırmacılar küçük halkasal peptitlerin kendi kendine birleşerek oluşturduğu minik içi boş silindirler ‘yani peptid nanotüpler’ kullandı. Bu nanotüpler, kemoterapi ilaçlarını doğrudan dirençli kanser hücrelerinin çekirdeğine taşıyarak, doxorubisin gibi uzun süredir kullanılan ilaçların etkisini yeniden canlandırıyor. Ayrıca kanser hücrelerinin bu ilaçları etkisiz hale getirme veya dışarı atma mekanizmalarını devre dışı bırakıyor.
Moleküler Bir Truva Atı
Doxorubisin, DNA’ya bağlanarak hücre bölünmesini durduran en yaygın kemoterapi ajanlarından biridir. Ancak çok sayıda yan etkisi vardır ve pek çok tümör, bu ilaca karşı “efluks pompaları” adı verilen moleküler savunma sistemlerini aktive ederek, ilacı çekirdeğe ulaşmadan hücre dışına atmayı öğrenebilmektedir. Bu durum olduğunda ise ilacın kansere karşı etkisi kalmamaktadır.
Araştırmanın baş yazarı Dr. Juan R. Granja liderliğindeki CiQUS ekibi, bu savunmayı aşabilecek halkasal peptitler tasarladı. Bu peptit halkalar, sağ ve sol elli amino asitlerin dönüşümlü dizilimi sayesinde hem hidrofilik hem hidrofobik (amfipatik) özellik kazanıyor. Ayrıca pozitif yüklü (katyonik) yapıları sayesinde, negatif yüklü ve lipid açısından zengin kanser hücre zarlarıyla güçlü bir şekilde etkileşebiliyor.
Yaşayan Turuva Atı: Bakterilere Gizlenen Virüsler Kanser Tedavisinde Başarılı Oldu
Doxorubisin bu halkasal peptitlerle bağlandığında, ortaya süpramoleküler nanotüpler çıkıyor. Bu yapılar, tümör zarına bağlandıktan sonra endositoz yoluyla hücre içine alınıyor. Ardından, zar bozucu özellikleri sayesinde endozomlardan kurtularak hem ilacı hem de peptidi çekirdeğe salıyor.
Kanser Hücrelerinin Zayıf Noktasını Hedefliyor
Kanser hücreleri, yüzeylerinde fosfatidilserin gibi negatif yüklü fosfolipitlerin bol bulunduğu anormal zar özelliklerine sahiptir. Sağlıklı hücrelerde bu özellik çok nadir görülür. Peptid nanotüpler, işte bu farkı avantaja çevirerek tümör hücrelerine yüksek seçicilik gösterir; normal dokulara ise minimal zarar verir. Mikroskobik ve biyokimyasal testler, bu peptid–ilaç konjugatlarının dirençli hücrelere etkin şekilde girdiğini ve doxorubisinin hücre öldürücü etkisini uzun süre koruduğunu gösterdi. İlginç şekilde, peptitlerin kendisi de çekirdeğe ulaşarak ilacın etkinliğini artırabilecek sinerjik etkilere yol açıyor.
Yeni Nesil Tedavilere Kapı Aralayan Bir Sistem
Bu yaklaşım sadece tek bir ilaca özgü değil. Araştırmacılar, peptid dizilimini değiştirerek, başka kemoterapi ajanlarına veya hedefe yönelik biyolojik ilaçlara uyarlanabilecek nanotüp kütüphaneleri oluşturabileceklerini düşünüyor. Ayrıca sistem, aynı anda birden fazla ilacı taşıyabilen kombinasyon tedavilerine de zemin hazırlayabilir.
Küresel Araştırma: CAR-T Hücre Tedavisi İkincil Kanser Riskini Artırıyor
Gelecekte bu nanotüpler, ilaç taşımanın yanı sıra moleküler sensörler veya görüntüleme ajanlarıyla birleştirilerek, kanser tedavisinin ilerleyişini gerçek zamanlı izleme olanağı da sunabilir. Araştırmacılara göre, bu çalışma sayesinde peptid diziliminin optimize edilmesiyle daha güçlü türevler geliştirilebilir, hatta her tümörün moleküler yapısına uyum sağlayan, yeni nesil akıllı kemoterapilerin önünü açabilir.
Kaynaklar ve Referanslar:
1- Molecular Trojan Horse: Peptide Nanotubes Offer a Path to Defeat Drug-Resistant TumorsYAZIYI PAYLAŞ


 Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri
Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri Kemoterapi nedir? Kanser tedavisinde nasıl uygulanır, yan etkileri nelerdir?
Kemoterapi nedir? Kanser tedavisinde nasıl uygulanır, yan etkileri nelerdir? Çocuk gelişimi ve psikolojisi: Gelişimini etkileyen faktörler
Çocuk gelişimi ve psikolojisi: Gelişimini etkileyen faktörler Prof. Dr. Fevzi Altuntaş: Yapay zeka lenfoma tedavi ve yönetiminde çığır açacak
Prof. Dr. Fevzi Altuntaş: Yapay zeka lenfoma tedavi ve yönetiminde çığır açacak Kanserde doğru sanılan yanlış bilgiler teşhisi geciktiriyor!
Kanserde doğru sanılan yanlış bilgiler teşhisi geciktiriyor!
YORUMUNUZ VAR MI?