Bazal hücre karsinomunda vismodegibe ilişkin pozitif sonuçlar
Roche, ilerlemiş bazal hücre karsinomunda Hedgehog Yolu İnhibitörüne ilişkin pozitif merkezi Faz II sonuçlarını açıkladı
 Roche, araştırma konusu Hedgehog Yolu İnhibitörü vismodegibe (RG3616/GDC-0449) ilişkin merkezi, Faz II klinik çalışmasının, özellikle şiddetli ve zayıf düşürücü bir deri kanseri formu olan ilerlemiş bazal hücre karsinomu (aBCC) olan kişilerde pozitif sonuçlar gösterdiğini duyurdu. Firma tarafından yapılan açıklamada ‘Çalışma, birincil sonlanım noktasını karşılamış ve vismodegibin, çalışmada önceden tanımlanmış oranda kişide tümörleri küçülttüğünü gösterdi. Ön güvenlilik değerlendirmesi, en yaygın advers olayların, vismodegib ile önceki deneyimle tutarlı olduğunu göstermiştir. Ayrıntılı bir güvenlilik değerlendirmesi devam etmektedir” denildi.
Roche, araştırma konusu Hedgehog Yolu İnhibitörü vismodegibe (RG3616/GDC-0449) ilişkin merkezi, Faz II klinik çalışmasının, özellikle şiddetli ve zayıf düşürücü bir deri kanseri formu olan ilerlemiş bazal hücre karsinomu (aBCC) olan kişilerde pozitif sonuçlar gösterdiğini duyurdu. Firma tarafından yapılan açıklamada ‘Çalışma, birincil sonlanım noktasını karşılamış ve vismodegibin, çalışmada önceden tanımlanmış oranda kişide tümörleri küçülttüğünü gösterdi. Ön güvenlilik değerlendirmesi, en yaygın advers olayların, vismodegib ile önceki deneyimle tutarlı olduğunu göstermiştir. Ayrıntılı bir güvenlilik değerlendirmesi devam etmektedir” denildi.
 Sonuçları yeni açıklanan çalışma ile ilgili değerlendirmelerde bulunan Roche Global Ürün Geliştirme Başkanı ve Sağlık Direktörü Hal Barron, şu bilgileri verdi: “Görünüm bozukluğuna yol açan ve potansiyel olarak yaşamı tehdit edici, ilerlemiş deri kanseri formu olan kişilerde onaylanmış tedavi seçenekleri şu anda bulunmadığından, bu sonuçlar önemlidir. Çalışma verilerini daha ayrıntılı olarak sunmak ve sonuçları dünya çapındaki sağlık kurumları ile tartışmak için sabırsızlanıyoruz.”
Sonuçları yeni açıklanan çalışma ile ilgili değerlendirmelerde bulunan Roche Global Ürün Geliştirme Başkanı ve Sağlık Direktörü Hal Barron, şu bilgileri verdi: “Görünüm bozukluğuna yol açan ve potansiyel olarak yaşamı tehdit edici, ilerlemiş deri kanseri formu olan kişilerde onaylanmış tedavi seçenekleri şu anda bulunmadığından, bu sonuçlar önemlidir. Çalışma verilerini daha ayrıntılı olarak sunmak ve sonuçları dünya çapındaki sağlık kurumları ile tartışmak için sabırsızlanıyoruz.”
Yapılan yazılı açıklamada, çalışmadan elde edilen verilerin yanık gelecekte bir tıp toplantısında sunulacağı belirtildi. Hedgehog sinyal yolu, yaşamın erken aşamalarında düzgün büyüme ve gelişmeyi düzenlemede önemli rol oynar ve ardından, yetişkinlerde daha az etkin hale gelir. Bununla birlikte, Hedgehog sinyalini yeniden reaktive eden yoldaki mutasyonlar, kanserin birkaç farklı tipinde görülür. Hedgehog yolundaki anormal sinyal, BCC vakalarının çoğunda yer alır. Roche, ayrıca Ekim 2010 tarihinde açılan ve BCC’nin ameliyat edilebilir formları olan kişilerde yapılan Faz II çalışmasında da vismodegibi değerlendirmektedir.
Faz II Klinik Çalışması hakkında (ERIVANCE BCC/SHH4476g)
 ERIVANCE BCC, lezyonları ameliyat için uygun olmayan ya da ameliyatın önemli ölçüde deformiteye yol açacağı şeklinde belirlenen, lokal olarak ilerlemiş ve/veya metastatik BCC dahil, aBCC’si olan 104 hastanın kaydedildiği, uluslararası, tek kollu, çok merkezli, iki kohortlu, açık etiketli bir Faz II klinik çalışmadır. Çalışma katılımcıları, hastalığın progresyonuna kadar günde bir kez 150mg vismodegib almıştır. Çalışmanın birincil sonlanım noktası, bağımsız inceleyiciler tarafından değerlendirilen genel yanıt oranıdır (tümör küçülmesi). Çalışmanın ikincil sonlanım noktaları, çalışma inceleyicileri tarafından değerlendirildiği üzere genel yanıt oranını, yanıt süresini, progresyonsuz sağkalımı, genel sağkalımı ve güvenlilik profilini içermiştir. Ön güvenlilik değerlendirmesi, en yaygın advers olaylar olarak kas spazmları, saç dökülmesi, tat alma duyusunda değişiklik, kilo kaybı, bitkinlik, bulantı, iştahta azalma ve ishali ortaya koymuştur. Ölümcül olaylar dahil, ciddi advers olaylar görülmüştür. Ölümler daha fazla değerlendirilmektedir, ancak vismodegib ile ilişkili görülmemektedir.
ERIVANCE BCC, lezyonları ameliyat için uygun olmayan ya da ameliyatın önemli ölçüde deformiteye yol açacağı şeklinde belirlenen, lokal olarak ilerlemiş ve/veya metastatik BCC dahil, aBCC’si olan 104 hastanın kaydedildiği, uluslararası, tek kollu, çok merkezli, iki kohortlu, açık etiketli bir Faz II klinik çalışmadır. Çalışma katılımcıları, hastalığın progresyonuna kadar günde bir kez 150mg vismodegib almıştır. Çalışmanın birincil sonlanım noktası, bağımsız inceleyiciler tarafından değerlendirilen genel yanıt oranıdır (tümör küçülmesi). Çalışmanın ikincil sonlanım noktaları, çalışma inceleyicileri tarafından değerlendirildiği üzere genel yanıt oranını, yanıt süresini, progresyonsuz sağkalımı, genel sağkalımı ve güvenlilik profilini içermiştir. Ön güvenlilik değerlendirmesi, en yaygın advers olaylar olarak kas spazmları, saç dökülmesi, tat alma duyusunda değişiklik, kilo kaybı, bitkinlik, bulantı, iştahta azalma ve ishali ortaya koymuştur. Ölümcül olaylar dahil, ciddi advers olaylar görülmüştür. Ölümler daha fazla değerlendirilmektedir, ancak vismodegib ile ilişkili görülmemektedir.
Bazal Hücre Karsinomu
BCC, Avrupa1, Avustralya2 ve ABD3’de deri kanserinin en yaygın tipidir. Genel yıllık insidans, dünya genelinde yaklaşık 2 milyon vakadır.4,5,6. Kanser derinin küçük bir alanıyla sınırlı olduğunda, hastalık genelde tedavi edilebilir olarak değerlendirilmektedir. Bununla birlikte, küçük bir insan grubunda, hastalığın tedavi edilmemesi ya da tedaviye yanıt vermemesi durumunda, kanser deriye, kemiklere veya diğer dokulara yayılabilir. Düşük oranda hastada (en az %1 olması tahmin edilmektedir), BCC, vücudun diğer bölümlerine ilerleyebilir ya da yayılabilir ve tedavi edilmesi zor veya yaşamı tehdit edici olabilir.
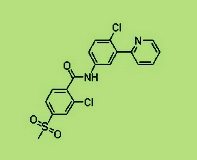
Vismodegib (RG3616/GDC-0449) ve Hedgehog Yolu
 GDC-0449’un, Dünya Sağlık Örgütü tarafından onaylanmış, vismodegib jenerik adına sahiptir. Vismodegib, Hedgehog yolundaki sinyali, “Smoothened” adlı proteini hedef alarak seçici biçimde inhibe etmek üzere tasarlanmış, sınıfında bir ilk olan, araştırma konusu bir oral ilaçtır. Roche, vismodegibi, Curis, Inc ile bir işbirliği anlaşması kapsamında geliştirmektedir. Vismodegib, Genentech tarafından keşfedilmiş, Genentech ve Curis tarafından bir dizi klinik öncesi çalışmayla ortaklaşa geliştirmiştir. Bu işbirliği ile, Genentech (ABD), Roche (Japonya hariç, ABD dışında) ve Chugai Pharmaceuticals (Japonya), vismodegibin klinik geliştirmesinden ve ticarileştirilmesinden sorumludur.
GDC-0449’un, Dünya Sağlık Örgütü tarafından onaylanmış, vismodegib jenerik adına sahiptir. Vismodegib, Hedgehog yolundaki sinyali, “Smoothened” adlı proteini hedef alarak seçici biçimde inhibe etmek üzere tasarlanmış, sınıfında bir ilk olan, araştırma konusu bir oral ilaçtır. Roche, vismodegibi, Curis, Inc ile bir işbirliği anlaşması kapsamında geliştirmektedir. Vismodegib, Genentech tarafından keşfedilmiş, Genentech ve Curis tarafından bir dizi klinik öncesi çalışmayla ortaklaşa geliştirmiştir. Bu işbirliği ile, Genentech (ABD), Roche (Japonya hariç, ABD dışında) ve Chugai Pharmaceuticals (Japonya), vismodegibin klinik geliştirmesinden ve ticarileştirilmesinden sorumludur.
Referanslar
1 N.R.Telfer, G.B.Colver and C.A.Morton. Guidelines for the management of basal cell carcinoma. The British Journal of Dermatology. 2008;158(7):35-48. Available at: (Last accessed 15 March 2011)
2Gilbody JS, et al. What causes basal cell carcinoma to be the commonest cancer? Aust J Public Health.1994; 18(2):218-21
3 Miller DL and Weinstock MA. Nonmelanoma skin cancer in the United States: incidence. Jam Acad Dermatol 1994; 30:774-8
4World Health Organization: https://www.who.int/news-room/questions-and-answers/item/radiation-ultraviolet-(uv)-radiation-and-skin-cancer Accessed August 10, 2010
5Diepgen TL, Mahler V. The epidemiology of skin cancer. Br J Dermatol 2002;146(suppl):1-6
6 Rubin AI et al. Basal-cell carcinoma. N Engl J Med. 2005 Nov 24;353(21):2262-9
YAZIYI PAYLAŞ


 Prof. Dr. Öksüzoğlu: Yerli akciğer kanseri ilacı Faz-1 aşaması bu yıl tamamlanabilir
Prof. Dr. Öksüzoğlu: Yerli akciğer kanseri ilacı Faz-1 aşaması bu yıl tamamlanabilir Roche, tek örnekten birçok patojeni test edebilen yeni test için anlaştı
Roche, tek örnekten birçok patojeni test edebilen yeni test için anlaştı Bazal hücreli karsinom tanı ve tedavisi
Bazal hücreli karsinom tanı ve tedavisi Tıbbi cihaz reklam ve tanıtımlarına yeni düzenleme getirildi
Tıbbi cihaz reklam ve tanıtımlarına yeni düzenleme getirildi Türkiye’nin onkoloji alanındaki ilk Faz 1 Kanser Klinik Araştırma Merkezi açıldı
Türkiye’nin onkoloji alanındaki ilk Faz 1 Kanser Klinik Araştırma Merkezi açıldı
YORUMUNUZ VAR MI?