Glivec, GİST kanserinde Türkiye’de de ruhsat aldı
GİST hastalarında, rekürensini azaltan ilk adjuvant tedavi
 Gastrointestinal stromal tümor hastalarında, kanserin tekrarlama riskini azaltan ilk adjuvant tedavi olan Glivec, Türkiye’de de ruhsat aldı. Novartis İlaç, tarafından yapılan açıklamaya göre, “Glivec’in yetişkin KIT-pozitif gastrointestinal stromal tümor (GİST) hastalarında, tümörün cerrahiyle tam olarak alınması sonrasında rekürens riskini azaltmak üzere 1 yıl süreyle adjuvan tedavi olarak kullanımı, Sağlık Bakanlığı tarafından onaylandı.”
Gastrointestinal stromal tümor hastalarında, kanserin tekrarlama riskini azaltan ilk adjuvant tedavi olan Glivec, Türkiye’de de ruhsat aldı. Novartis İlaç, tarafından yapılan açıklamaya göre, “Glivec’in yetişkin KIT-pozitif gastrointestinal stromal tümor (GİST) hastalarında, tümörün cerrahiyle tam olarak alınması sonrasında rekürens riskini azaltmak üzere 1 yıl süreyle adjuvan tedavi olarak kullanımı, Sağlık Bakanlığı tarafından onaylandı.”
 Novartis İlaç, ruhsat aldığı ürün ve endikasyonu ile ilgili şu bilgileri verdi: “Erken evre GİST’te tedavi tümörün cerrahi olarak çıkarılmasıdır. Ancak tümörün alınmasını takiben her 2 GİST hastasından birinde tümör tekrarlamaktadır (rekürens)1. GİST hastalarında, primer tümörün cerrahi olarak çıkarılmasını takiben 1 yıl süreyle adjuvant Glivec kullanımı, rekürens riskini anlamlı oranda azaltarak fayda sağlamaktadır. Tümör rezeksiyonu sonrası Glivec tedavi koluna ayrılan GİST hastalarında 1 yıllık rekürenssiz sağkalım %98 olurken, plasebo koluna ayrılan hastalarda bu oran %83 olmuştur.
Novartis İlaç, ruhsat aldığı ürün ve endikasyonu ile ilgili şu bilgileri verdi: “Erken evre GİST’te tedavi tümörün cerrahi olarak çıkarılmasıdır. Ancak tümörün alınmasını takiben her 2 GİST hastasından birinde tümör tekrarlamaktadır (rekürens)1. GİST hastalarında, primer tümörün cerrahi olarak çıkarılmasını takiben 1 yıl süreyle adjuvant Glivec kullanımı, rekürens riskini anlamlı oranda azaltarak fayda sağlamaktadır. Tümör rezeksiyonu sonrası Glivec tedavi koluna ayrılan GİST hastalarında 1 yıllık rekürenssiz sağkalım %98 olurken, plasebo koluna ayrılan hastalarda bu oran %83 olmuştur.
 Glivec’in yetişkin KIT-pozitif gastrointestinal stromal tümor (GİST) hastalarında, tümörün cerrahiyle tam olarak alınması sonrasında rekürens riskini azaltmak üzere 1 yıl süreyle adjuvan tedavi olarak kullanımı, Sağlık Bakanlığı tarafından 25.03.2011 tarihinde onaylanmıştır. GİST’te başlıca tedavi yaklaşımı tümörün cerrahi olarak çıkarılmasıdır. Ancak tümör tam olarak çıkarılsa bile rekürens gelişme riski vardır. Rekürens riski tümörün sindirim siteminde yerleştiği bölge, tümörün boyutları ve histopatolojik inceleme ile belirlenen mitoz oranı gibi özelliklerine göre değişmektedir. Tümörün çıkarılmasını takiben her iki hastadan birinde rekürens gelişmektedir.1 Yüksek riskli hastalarda rekürens gelişimi neredeyse kaçınılmazdır.3
Glivec’in yetişkin KIT-pozitif gastrointestinal stromal tümor (GİST) hastalarında, tümörün cerrahiyle tam olarak alınması sonrasında rekürens riskini azaltmak üzere 1 yıl süreyle adjuvan tedavi olarak kullanımı, Sağlık Bakanlığı tarafından 25.03.2011 tarihinde onaylanmıştır. GİST’te başlıca tedavi yaklaşımı tümörün cerrahi olarak çıkarılmasıdır. Ancak tümör tam olarak çıkarılsa bile rekürens gelişme riski vardır. Rekürens riski tümörün sindirim siteminde yerleştiği bölge, tümörün boyutları ve histopatolojik inceleme ile belirlenen mitoz oranı gibi özelliklerine göre değişmektedir. Tümörün çıkarılmasını takiben her iki hastadan birinde rekürens gelişmektedir.1 Yüksek riskli hastalarda rekürens gelişimi neredeyse kaçınılmazdır.3
 Bugüne kadar tümörü operasyonla çıkarılmış ancak rekürens riski yüksek olan GİST hastaları için bir tedavi bulunmamaktaydı. Glivec şu anda, bu tümörün tekrarlamasını geciktirmek için endike olan tek adjuvan tedavi olarak, GİST hastalarının önemli bir ihtiyacını karşılamaktadır. Sağlık Bakanlığı Glivec’in aşağıdaki özellikleri taşıyan yüksek riskli GİST hastalarında, tümörün cerrahi olarak çıkarılması sonrasında 1 yıl süreyle kullanımı için onaylamıştır: “Mide yerleşimli alanlarda tümör büyüklüğü 6cm’in üzerinde olan ve mitoz oranı 5’in üzerinde olanlar, Mide dışındaki yerleşimlerde 10cm ve üzerinde tümör büyüklüğü olan ya da mitoz oranı 5’in üzerinde olanlar”
Bugüne kadar tümörü operasyonla çıkarılmış ancak rekürens riski yüksek olan GİST hastaları için bir tedavi bulunmamaktaydı. Glivec şu anda, bu tümörün tekrarlamasını geciktirmek için endike olan tek adjuvan tedavi olarak, GİST hastalarının önemli bir ihtiyacını karşılamaktadır. Sağlık Bakanlığı Glivec’in aşağıdaki özellikleri taşıyan yüksek riskli GİST hastalarında, tümörün cerrahi olarak çıkarılması sonrasında 1 yıl süreyle kullanımı için onaylamıştır: “Mide yerleşimli alanlarda tümör büyüklüğü 6cm’in üzerinde olan ve mitoz oranı 5’in üzerinde olanlar, Mide dışındaki yerleşimlerde 10cm ve üzerinde tümör büyüklüğü olan ya da mitoz oranı 5’in üzerinde olanlar”
Bu onay, ABD Ulusal Kanser Enstitüsü’nün sponsorluğunda yürütülen ve 1 yıl süreyle Glivec ile tedavi edilen hastalarda plaseboya kıyasla GİST’in rekürens oranında etkileyici azalma gösteren faz III çalışmaya dayanıyor. Medyan 19.7 aylık takip sonuçlarına göre, 1 yılın sonunda Glivec kullanan hastaların %98’inde kanser tekrarlamazken, aynı oran plasebo kolundaki hastalarda %83 olmuştur.2
Çalışmanın medyan 20 aylık takip sonuçları Amerikan Klinik Onkoloji Derneği’nin (ASCO) 2010 Gastrointesitinal Kanserler Sempozyumu’nda sunuldu.4 Bir yıl süreyle Glivec kullanan hastalarda 2. yılda rekürenssiz hasta oranı %91, plasebo kolundaki hastalarda ise %74 olmuştur. Çalışmaya dahil edilen hastalar rekürens riski açısından alt gruplara ayrılarak incelendiğinde ise, yüksek riskli hastalarda 2 yıllık rekürenssiz sağkalım Glivec kolundaki hastalarda %77, plasebo kolundaki hastalarda ise %41 olmuştur (p < 0.0001). Glivec’in adjuvan tedavide daha uzun süreli kullanımına ilişkin çalışmalar devam etmektedir.
Çalışma Hakkında
 Ruhsat onayının dayandığı veriler, tümörleri cerrahi olarak çıkarılan 700’den fazla GİST hastasının katıldığı, faz III, çift-kör, randomize, çok merkezli, uluslararası çalışmadan elde edildi. Çalışmanın etkinlik için sonlanım noktası, hastaların çalışmada bir tedavi koluna ayrılma tarihinden, hastalığın tekrarlaması veya herhangi bir nedenle ölüme kadar geçen süre olarak tanımlanan rekürenssiz sağkalımdır (RS). Katılımcılar 1 yıl süreyle, 400 mg/gün Glivec veya plasebo alacak şekilde randomize edilmişlerdir. Çalışmanın sonuçları 2009’da Lancet dergisinde yayınlanmıştır.2
Ruhsat onayının dayandığı veriler, tümörleri cerrahi olarak çıkarılan 700’den fazla GİST hastasının katıldığı, faz III, çift-kör, randomize, çok merkezli, uluslararası çalışmadan elde edildi. Çalışmanın etkinlik için sonlanım noktası, hastaların çalışmada bir tedavi koluna ayrılma tarihinden, hastalığın tekrarlaması veya herhangi bir nedenle ölüme kadar geçen süre olarak tanımlanan rekürenssiz sağkalımdır (RS). Katılımcılar 1 yıl süreyle, 400 mg/gün Glivec veya plasebo alacak şekilde randomize edilmişlerdir. Çalışmanın sonuçları 2009’da Lancet dergisinde yayınlanmıştır.2
Medyan 19.7 aylık takip sonucunda, Glivec tedavi kolundaki 359 hastada rekürens ile ilgili 30 olay gözlenirken (%8), plasebo kolundaki 354 hastada 70 olay (%20) görülmüştür (Hasar oranı=0,398) [%95 Güvenlik aralığı: 0.259, 0.610], p<0.0001). Bu takip süresi sağkalımı değelendirmek için çok kısadır.2
ACOSOG Z90001 olarak bilinen çalışma, ABD ve Kanada’da çok sayıda merkezde ve Novartis ve ABD Ulusal Kanser Enstitüsü (NIH) arasında Kurumsal Araştırma ve Geliştirme Anlaşması çerçevesinde gerçekleştirilmiştir.
Araştırmacılar Glivec’in daha önceki klinik çalışmalarda görülenlere benzer yan etkilerle hastaların çoğunda iyi tolere edildiğini bildirmişlerdir. Adjuvan GİST tedavisinde, rezeke edilemeyen ve/veya malign metastatik GİST dahil diğer hasta gruplarında daha önce bildirilmeyen yeni bir advers olay bildirilmemiştir.2
Gastrointestinal Stromal Tümorler (GİST)
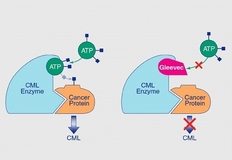
 GİST sindirim sistemindeki organları destekleyen bağ dokudan kaynaklanan kötü huylu bir tümördür. GİST sindirim sisteminde herhangi bir yerde gelişebilmekle birlikte, en sık midede ve ince bağırsakta yerleşmektedir. GİST’lerin %95’inde KIT (veya CD117) olarak adlandırılan özel bir reseptör mutasyona uğramıştır. Bu nedenle tümör bazen KIT pozitif veya CD 117 pozitif GİST olarak adlandırılır. Normal KIT proteini hücre büyümesini ve bölünmesini kontrol eder. Ancak KIT proteini mutasyona uğradığında, hücrelere sürekli olarak büyüme sinyali gönderir ve sindirim kanalı boyunca GİST gelişimine neden olur. Glivec mutasyona uğramış KIT’e bağlanarak, anormal sinyalleri bloke eder. Bunun sonucunda GİST hücrelerinin azalması ve eliminasyonu mümkün olabilmektedir. Glivec ülkemizde 2003’de opere edilemeyen veya metastatik ileri evre GİST hastalarında kullanım onayı almıştır ve bu hastalarda 19 ay olan medyan sağkalım süresini 57 aya uzatmıştır.5 Glivec ayrıca Ph+ Kronik miyeloid löseminin tüm evrelerinde kullanım onayına sahiptir.
GİST sindirim sistemindeki organları destekleyen bağ dokudan kaynaklanan kötü huylu bir tümördür. GİST sindirim sisteminde herhangi bir yerde gelişebilmekle birlikte, en sık midede ve ince bağırsakta yerleşmektedir. GİST’lerin %95’inde KIT (veya CD117) olarak adlandırılan özel bir reseptör mutasyona uğramıştır. Bu nedenle tümör bazen KIT pozitif veya CD 117 pozitif GİST olarak adlandırılır. Normal KIT proteini hücre büyümesini ve bölünmesini kontrol eder. Ancak KIT proteini mutasyona uğradığında, hücrelere sürekli olarak büyüme sinyali gönderir ve sindirim kanalı boyunca GİST gelişimine neden olur. Glivec mutasyona uğramış KIT’e bağlanarak, anormal sinyalleri bloke eder. Bunun sonucunda GİST hücrelerinin azalması ve eliminasyonu mümkün olabilmektedir. Glivec ülkemizde 2003’de opere edilemeyen veya metastatik ileri evre GİST hastalarında kullanım onayı almıştır ve bu hastalarda 19 ay olan medyan sağkalım süresini 57 aya uzatmıştır.5 Glivec ayrıca Ph+ Kronik miyeloid löseminin tüm evrelerinde kullanım onayına sahiptir.
Referanslar
1. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. Soft tissue sarcoma. V1. 2011. https://www.nccn.org/. Erişim tarihi, Nisan 2011.
2. DeMatteo, R., et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 2009;373:1097-104.
3. Corless C et al. Biology of Gastrointestinal Stromal Tumors. J Clin Oncol 22:3813-3825.
4. Blackstein ME et al. Risk assessment for tumor recurrence after surgical resection of localized primary gastrointestinal stromal tumor (GIST): North American Intergroup phase III trial ACOSOG Z9001. Abstract presented at ASCO 2010 Gastrointestinal Cancers Symposium. Abstract no:6.
5. Blanke CD, Demetri CD, von Mehren M, Heinrich MC et al. Long term results from a randomized phase ıı trial of standart- versus higher-dose ımatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. Journal of Clinical Oncology 2008;26(4): 620-625.
http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(09)60500-6/abstract
YAZIYI PAYLAŞ


 Gastrointestinal Stromal Tümörlerin tedavisinde yeni ilaç seçenekleri artıyor
Gastrointestinal Stromal Tümörlerin tedavisinde yeni ilaç seçenekleri artıyor Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri
Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri Şiddetli baş ağrısı beyin tümörünün habercisi olabilir
Şiddetli baş ağrısı beyin tümörünün habercisi olabilir Erken evre meme kanserinde hasta seçimi ve teknik standartlar
Erken evre meme kanserinde hasta seçimi ve teknik standartlar Kanseri ilacı Afinitor Türkiye’de de ruhsat aldı
Kanseri ilacı Afinitor Türkiye’de de ruhsat aldı
YORUMUNUZ VAR MI?