 Günümüzde erken evre meme kanseri olan bazı hastaların tedavisinde mastektomi (radikal ya da modifiye radikal) halen uygun olmaya devam etmekle birlikte, meme koruyucu tedavi de pek çok hastada tercih sebebi olduğunu belirten Kocaeli Üniversitesi Tıp Fakültesi Genel Cerrahi Anabilim Dalı’ndan Dr. N. Zafer Utkan, Erken evre meme kanserinde hasta seçimi ve teknik standartları konusunda Meme Kanseri Konferansı ve Ulusal Meme Kanseri Konsensus Toplantısı’nda yaptığı sunum şu şekilde;
Günümüzde erken evre meme kanseri olan bazı hastaların tedavisinde mastektomi (radikal ya da modifiye radikal) halen uygun olmaya devam etmekle birlikte, meme koruyucu tedavi de pek çok hastada tercih sebebi olduğunu belirten Kocaeli Üniversitesi Tıp Fakültesi Genel Cerrahi Anabilim Dalı’ndan Dr. N. Zafer Utkan, Erken evre meme kanserinde hasta seçimi ve teknik standartları konusunda Meme Kanseri Konferansı ve Ulusal Meme Kanseri Konsensus Toplantısı’nda yaptığı sunum şu şekilde;
Meme koruyucu tedavi; primer tümörün çevre meme dokusu ile birlikte eksizyonu ve takiben radyoterapiyi içerir. Meme koruyucu cerrahi ise; lumpektomi, parsiyel mastektomi ve segmental mastektomi olarak tanımlanır. (1)
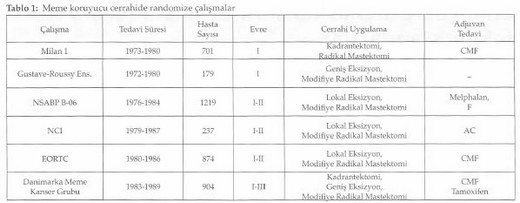
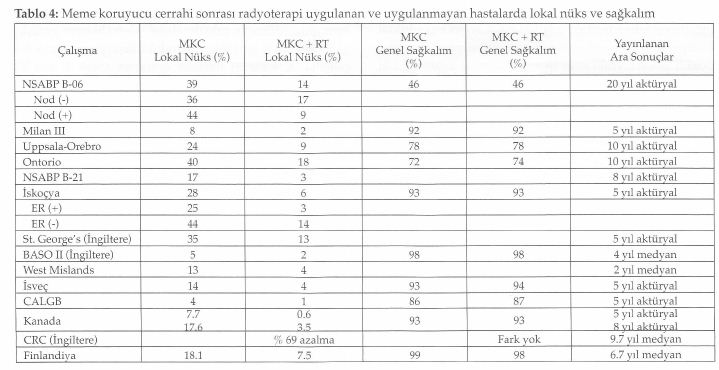
2000’li yılların başında uzun dönem sonuçları yayınlanan altı prospektif randomize çalışmayı özetleyen Tablo l’de de görüldüğü gibi hastalık evresi I, II ve bir çalışmada da III olanlar çalışmaya dahil edilmişlerdi. Meme koruyucu cerrahi kolunda uygulanan primer girişim, kadrantektomi ya da lumpektomi gibi farklı hacimde rezeksiyon materyallerini içermekte ve adjuvan tedavi seçenekleri de farklılıklar göstermekteydi. Gruplar heterojen olsa da çalışmalarda, meme koruyucu tedavi yapılanlar ile mastektomi uygulanan hastalar arasında genel ve hastalıksız sağkalım oranlarının benzer olduğu görüldü.
Memenin korunması halinde gerek çıkarılan tümör yatağında ya da aynı kadranda gerekse aynı memede farklı kadranda tümör nüksü öngörülebilir. Bahsedilen altı çalışmanın dördünde meme koruyucu cerrahi ile mastektomi arasında lokal nüks açısından fark olmadığı görüldü. Meme koruyucu tedavi yapılan hastalarda 10 yıllık lokal nüks oranı % 5 ile % 10 arasında yani yılda % l’den daha az olarak gerçekleşmektedir. En yüksek lokal nükse sahip NCI çalışmasında çıkarılan tümörün yalnızca makroskopik cerrahi sınır değerlendirmesi yapılmıştır. Hastaların yaklaşık % 81’i T2 tümöre ve % 48’i de pozitif cerrahi sınıra sahip olan EORTC çalışmasında da benzer şekilde lokal nüks oranının daha yüksek olduğu bulunmuştur (2). Yine bu tabloda da görüldüğü gibi mastektomi yapılması lokal nüks gelişmesine engel olamamaktadır. Bu çalışmaların sonucunda meme koruyucu tedavi yapılan hastalarda lokal nüks gelişmesi; uygun olmayan hasta seçimi, yetersiz cerrahi ya da radyoterapi uygulaması veya biyolojik olarak agresif hastalık varlığına bağlanmıştır. Daha kaliteli mamografi, daha iyi patolojik değerlendirme, sistemik tedavilerin yaygın kullanımı ve radyoterapi uygulamalarındaki ilerlemeler ile meme koruyucu tedavi sonrası lokal nüks oranlarında azalma olduğu görülmektedir (2,3,4,5,6,7,8).
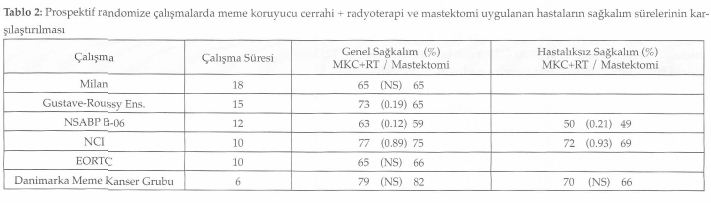
Tablo 4’de de görüldüğü gibi cerrahi sonrası radyoterapi uygulaması çalışmaların çoğunda lokal nüks oranlarının azalmasını sağlamıştır (2) Bu nedenle radyoterapi, meme koruyucu tedavinin önemli bir kom-ponentidir. Sektör rezeksiyonu yapılan ve radyoterapi alan ve almayan aksular lenf nodülü tutulumu negatif toplam 1178 hastayı kapsayan bir retrospektif çalışmada, hastalar tedaviden sonra ilk gelişen olay (ipsilateral tümör nüksü, aksular nüks, uzak metastaz ve meme dışı kanserden ölüm) açısından değerlendirilmiş ve radyoterapi almayanlarda lokal nüksün dikkat çekici olarak öne çıktığı görülmüştür (9). Günümüzde tümörün yalnızca geniş eksizyonu ile sınırlı bir tedavinin kullanılması konusu net değildir. Bu konuda titiz hasta seçimi yapılmış fakat hasta sayıları az olan çalışmaların sonuçları, hasta ve tümör karakteristiklerini gösteren yeni belirteçlere gereksinim olduğuna işaret etmektedirler . Radyoterapinin yerine sistemik tedavinin kullanılıp kullanılmayacağını araştıran NSABP B-21 çalışmasında, 8 yıllık kü-mülatif lokal nüks oranı tek başına tamoksifende % 16.5, radyoterapide % 9.3 ve tamoksifen ile radyoterapi kombinasyonunda % 2.8 olarak bulunmuştur. Bu çalışma ile tamoksifenin radyoterapinin yerini alamayacağı ancak birlikte kullanılmasının sinerji yaratacağı görülmüştür. Bu çalışmada genel sağkalım her iki kolda da benzerlik göstermektedir (10). CALGB ve Kanada çalışmalarında lokal nüks oranlarındaki dikkat çeken azalma nedeni ile cerrahi sınır negatif olmak şartıyla 70 yaş ve üzeri, lenf nodülü tutulumu negatif, östrojen reseptörü pozitif olan hastalarda cerrahi sonrası hormonal tedavinin tek başına kullanılmasının önerilebileceği bildirilmiştir (11, 12).
Erken evre meme kanserinde hasta seçimi
Meme koruyucu tedavi uygulamasını etkileyen ya da güçleştiren faktörler, hastaya ve tümöre ait olmak üzere incelenebilir(1,13,14). Hastaya ait faktörler; yaş, ırk, sosyoekonomik durum, radyoterapi imkanlarına ulaşabilme güçlüğü, radyoterapiye güvensizlik ve korkudur. Tümöre ait faktörler ise; mamografide yaygın kalsifikasyonlar, multi-sentrisite, temiz cerrahi sınır elde edilmesindeki güçlük, meme ve tümör büyüklüğü arasındaki oran ve radyoterapi için kontrendikasyon olup olmadığıdır. Bu nedenle hasta seçimi çok önemlidir.
Meme koruyucu tedavide hasta seçiminde değerlendirme aşağıdaki kriterler çerçevesinde yapılmalıdır (2):
1-Anamnez ve fizik muayene
2-Mamografik değerlendirme
3-Cerrahi spesmenin histolojik değerlendirmesi
4-Hasta tercih ve beklentilerinin değerlendirilmesi
1-a-Anamnezde
- Aile anamnezi: meme kanseri öyküsü (tanı sırasında yaş, bilateralite), över kanseri öyküsü
- Önceden meme ve göğüs duvarına tedavi edici radyasyon alma öyküsü
- Kollajen damar hastalığı öyküsü: tipi, tanı dokümanı
- Meme protezi varlığı: submamaryal ya da sub-pektoral
- Son menstruel siklusun tarihi, gebelik olasılığı
- Metastaz semptomları varlığı
- Meme başı akıntısı: renk, spontan olup olmadığı
2-a- Fizik Muayenede
Palpe edilebiliyorsa tümör çapı ve yeri Deriye fiksasyon
Meme ve tümör büyüklüğünün oranı Multipl tümör varlığı Aksillar nodul durumu: çap, fiksasyon Supraklaviküler lenf nodülü varlığı Lokal ileri kanser belirtisi Deri ülserasyonu, intradermal tümör nodülleri Peau d’orange Deride eriteni, ödem Fikse aksillar lenf nodülü Aynı taraf kolda lenfödem
(Deri, meme başı veya meme parankimindeki retraksiyon lokal ileri kanser belirtisi kabul edilmemektedir dolayısıyla meme koruyucu cerrahi için kontrendikasyon sayılmazlar)
- Meme başı değişiklikleri
- Karşı meme ve aksillanm görünümü
2-b- Mamografik değerlendirmede
- Hastalığın yaygınlığı
- Multisentrisitenin varlığı ya da yokluğu
- Karşı memenin değerlendirmesi
- Tümörün iki boyutlu büyüklüğünün saptanması
- Kitle etrafındaki meme cildinin kalınlığı

- Varsa mikrokalsifikasyonun yaygınlığı
- Birden fazla mikrokalsifikasyon kümesi varsa lokalizasyonları
- Gerekiyorsa magnifikasyon ya da spot komp-resyonla mikrokalsifikasyonlarm karakterleri ve kitle sınırlarının belirlenmesi
Biyopsi ya da kesin cerrahi uygulama öncesi yeni elde edilen (üç ay içinde) mamografi ve ultrasonografi yardımı ile olguların en az % 95’inde meme koruyucu cerrahiye uygun olup olmadıkları saptanabilir (15, 16).
3- Cerrahi spesmenin histolojik değerlendirmesinde;
- Histolojik tip
- Histolojik evre
- Tümör nekrozu
- Vasküler invazyon
- Lenfatik invazyon
- İnflamatuar infiltrasyon.
- İnvazif duktal karsinom ile birlikte duktal karsinoma in situ varlığı
- Rezeksiyon sınırları
- Patolojik nodul durumu
İnvazif duktal karsinoma dışındaki histolojik tiplerde lokal nüksün daha yüksek olduğu gösterilememiştir. Ancak biyolojik özellikleri nedeni ile cerrahi sınır kontrolü güç olduğundan primer tümör histolojisi infiltra-tif lobüler karsinom ya da duktal karsinoma in situ ise reeksizyon materyalinde rezidü kansere iki kat kadar daha çok rastlandığı belirtilmektedir (17, 18, 19). Bir başka çalışmada, tümör yatağı pozitifliği, duktal karsi-nomada % 22 iken lobüler karsinomada % 57 olarak bulunmuştur (20). Bu nedenle lobüler karsinomada tümör eksizyon materyali hacmi daha fazladır (21). Tümör diffüz değilse ve cerrahi negatif sınırlar sağlanarak tam eksizyon yapılabiliyorsa lobüler karsinoma in situ’nun eşlik ettiği ya da etmediği lobüler karsinomlu hastalar da meme koruyucu tedavi için adaydırlar (2).
Tümör evresi arttıkça reeksize edilen spesmende rezidü kanserle karşılaşma oranının arttığı, yüksek grad-lı tümörlerin düşük gradlı olanlardan daha fazla lokal nüks riskine sahip olduğu bildirilmiştir (22, 23).
 İnvazif duktal karsinom nedeni ile meme koruyucu cerrahi uygulanan kadınların yaklaşık % 20′ sinde yaygın intraduktal komponent pozitifliği vardır. Bu duruma daha sık olarak genç kadınlarda rastlanır. Evre I ve II meme kanserli 17931 hastayı kapsayan ve meme koruyucu tedavi için uygun olmayan hastaların saptanmasını amaçlayan bir çalışmada invazif kanserle birlikte bulunan yaygın intraduktal komponentin varlığı başta olmak üzere yaş, sağlık güvencesi, coğrafik loka-lizasyon ve düşük eğitim seviyesinin mastektomi yapılması kararını kolaylaştırdığı görülmüştür (24). Yaygın intraduktal komponent varlığı, hastalığın meme içinde klinik olarak değerlendirildiğinden daha yaygın olduğunu gösteren bir patolojik prediktör olarak kabul edilir ancak lokal nüks için bağımsız bir risk faktörü olarak görülmez. Yaygın intraduktal komponentin pozitifliğinde 10 yılda nüks oranı % 22 ile 32 arasında ise de cerrahi sınır negatifliği sağlandığında lokal nüks riskinin belirgin oranda azaldığı bilinmektedir. Eksize edilen tümör içindeki meme koruyucu cerrahi yapılmasına engel olacak intraduktal komponent yüzdesi kantitatif olarak tanımlanmamıştır. Lenfovasküler invazyon varlığında da lokal nüks oranı 5 yılda % 10 ile 15 arasında bulunmuştur. Gerek yaygın intraduktal komponent gerekse lenfovasküler invazyon pozitifliğinde birçok çalışmada önerildiği gibi daha geniş bir rezeksiyon hacmi sağlanması önemlidir. Ayrıca aynı şekilde cerrahi sınırda lo-büler karsinoma in situ, atipik duktal ya da lobüler hi-perplazi bulunması da reeksizyon yapmayı veya meme koruyucu cerrahiden vazgeçmeyi gerektiren bir faktör olarak görülmemektedir. (23, 25, 26, 27).
İnvazif duktal karsinom nedeni ile meme koruyucu cerrahi uygulanan kadınların yaklaşık % 20′ sinde yaygın intraduktal komponent pozitifliği vardır. Bu duruma daha sık olarak genç kadınlarda rastlanır. Evre I ve II meme kanserli 17931 hastayı kapsayan ve meme koruyucu tedavi için uygun olmayan hastaların saptanmasını amaçlayan bir çalışmada invazif kanserle birlikte bulunan yaygın intraduktal komponentin varlığı başta olmak üzere yaş, sağlık güvencesi, coğrafik loka-lizasyon ve düşük eğitim seviyesinin mastektomi yapılması kararını kolaylaştırdığı görülmüştür (24). Yaygın intraduktal komponent varlığı, hastalığın meme içinde klinik olarak değerlendirildiğinden daha yaygın olduğunu gösteren bir patolojik prediktör olarak kabul edilir ancak lokal nüks için bağımsız bir risk faktörü olarak görülmez. Yaygın intraduktal komponentin pozitifliğinde 10 yılda nüks oranı % 22 ile 32 arasında ise de cerrahi sınır negatifliği sağlandığında lokal nüks riskinin belirgin oranda azaldığı bilinmektedir. Eksize edilen tümör içindeki meme koruyucu cerrahi yapılmasına engel olacak intraduktal komponent yüzdesi kantitatif olarak tanımlanmamıştır. Lenfovasküler invazyon varlığında da lokal nüks oranı 5 yılda % 10 ile 15 arasında bulunmuştur. Gerek yaygın intraduktal komponent gerekse lenfovasküler invazyon pozitifliğinde birçok çalışmada önerildiği gibi daha geniş bir rezeksiyon hacmi sağlanması önemlidir. Ayrıca aynı şekilde cerrahi sınırda lo-büler karsinoma in situ, atipik duktal ya da lobüler hi-perplazi bulunması da reeksizyon yapmayı veya meme koruyucu cerrahiden vazgeçmeyi gerektiren bir faktör olarak görülmemektedir. (23, 25, 26, 27).
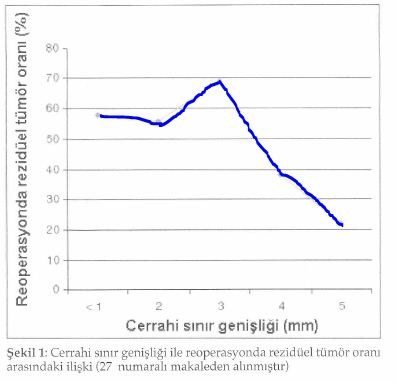
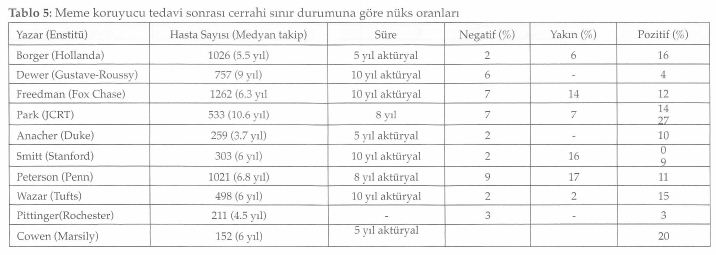
Cerrahi rezeksiyon sınırı, meme koruyucu cerrahi seçiminde en etkili belirleyicilerden biridir ve lokal kontrolü sağlamak için son derece önemlidir. Tablo 5’de de görüldüğü gibi oranlar farklı olmakla birlikte invazif karsinomları içeren çalışmaların çoğunda cerrahi sınır ile lokal nüks arasında ilişki vardır(13). Çalışmalarda görülen nüks oranlarındaki değişiklikler, primer tümörün cerrahi sınırdaki yayılmama, yaygın intraduktal komponentin olup olmamasına, pozitif sınırın tanımına, pozitif gelen cerrahi sınır sayısına ve sımr pozitifliğinin yaygınlığına bağlıdır. Pozitif sınır, spesmenin cerrahi kesit yüzeyinde tümör hücreleri bulunması şeklinde tamamlanmıştır. Pek çok çalışmada görüldüğü gibi pozitif sınıra sahip hastalarda takip süresi uzadıkça nüks gelişme oranı da artmaktadır. Pozitif sımr, meme koruyucu tedavi yapılmış invazif meme kanseri olan hastalarda hastalığa spesifik kötü prognozun bağımsız prediktörüdür. Negatif sınır tanımı ise literatürde değişiklikler göstermektedir ve kabul edilebilir sınır negatifliği kantitatif olarak halen tanımlanmamıştır. Bununla beraber negatif sınır ne kadar olursa olsun lokal nüks olasılığı tamamen yok olmamaktadır. Bu nedenle lokal nüks gelişme olasılığının cerrahi sınır durumu kadar preope-ratif ya da tümör karakterleri gibi başka faktörlerle de ilişkilendirilmesinin yanlış değildir. Tümörsüz cerrahi sınırın ne kadar olacağını destekleyen kanıta dayalı bilgi yoksa da ilk cerrahi uygulamada geniş bir negatif sınır elde edilmeye çalışılmalıdır. Cerrahi sınır genişliği ile rezidüel hastalık arasındaki ilişkiyi araştıran bir çalışmada, rezidüel hastalık oranının ancak 5 mm’lik sınır sağlanması halinde azalabileceği belirtmektedirler (28). Ancak pek çok radyasyon onkologu 1-2 göre nüks oranları mm’lik genişliği yeterli bulmaktadırlar.
Lezyonun geniş eksizyonundan sonra tümör yatağının tıraşlanarak reeksize edilmesi de önerilmektedir. Tümör kavitesi eksizyonu ile en azından 1 cm’lik negatif cerrahi sımr sağlanabilir. Ancak her hasta buna uygun olmayabilir. Ameliyat alanına bitişik yapılar göz önüne alınarak cerrahi sınır durumunu yorumlamak da önemlidir. Örneğin; eğer pektoral fasya rezeke edildi ise derin (posterior) cerrahi sımr pozitifliği anlamlı değildir( 1, 8, 15, 29, 30).
Yakın cerrahi sınır tanımı da değişiklikler göstermektedir. Bir çalışmada, aynı doz radyoterapi almış 1 mm yakın cerrahi sınıra sahip hastalarla, 1 mm cerrahi sınırdan daha geniş sınıra sahip hastalar arasında lokal nüks açısından fark bulunamamıştır. Yazarlar yakın cerrahi sınıra sahip özellikle genç hastalarda ve yaygın intraduktal komponent varlığında reeksizyon gereksinimine dikkat çekmişlerdir (31).
Preoperatif tanı; cerrahın terapötik eksizyon yapmasına ve daha geniş cerrahi sınır sağlayabilmesine izin verir. Dolayısıyla tedaviye geçiş süresi kısalır ve reeksizyon sayısı da azalır (1, 33).
Patolojik konsültasyon raporu şunları içermelidir (2):
- Spesmenin ne kadarı alınmıştır (parça sayısı, fik-satif, oryantasyon işaretleri)
- Eksize edilen dokunun kadranı ve lateralitesi
- Cerrahi uygulamanın tipi
- Ölçülebilen tümör boyutu, mikroskobik muayene ile doğrulanması
- Histolojik tip ve evre
- Birlikte duktal karsinoma in situ ya da yaygın intraduktal komponent varlığı
- Peritümöral vasküler ya da lenfatik invazyon varlığı
- Eksizyon sınırında makroskopik ya da mikros-kopik karsinom varlığı ya da yokluğu, sınırda tümör yoksa tümörün cerrahi sınıra uzaklığı mutlaka belirtilmeli
- Mikrokalsifikasyonlarm varlığı ve lokalizasyo-nu
- Lenf nodu durumu (spesmende bulunan lenf nodu sayısı, metastatik lenf nodu sayısı, en büyük metastatik lenf nodu ve lenf nodu kapsül invazyonu olup olmadığı)
- Östrojen ve progesteron reseptörleri ile HER2/ neu durumu
4- Hasta tercihi
Hasta ve hekim mutlaka uygulanması düşünülen tedavi stratejilerini tartışmalıdır. Buna fırsat vermesi içinde başlangıç tamsı mümkün olduğunca minimal invazif tam yöntemleri (ince iğne aspirasyon sitolojisi, kor biyopsi gibi) ile preoperatif dönemde sağlanmalıdır Tedavi seçeneklerinin; uzun süreli yaşam beklentisini karşılayıp karşılamadığı, lokal nüks olasılığı ve sonuçları ve tedavi sonrası kozmezis, seksüel adaptasyon, fonksiyonel yeterlilik ve fizyolojik durumu ne kadar değiştireceği hasta tarafından bilinmelidir. Pek çok hasta yaşam kalitesi farklı olmakla birlikte mastektomi ya da meme koruyucu tedavinin sağkalıma etkilerini önemsemezler. Mastektomi yapılan hastalar mastektomi ile kötü prognoz arasında ciddi korelasyon olduğunu, daha az agresif tedavi olduğu düşünülen meme koruyucu cerrahi yapılan hastalar ise daha iyi riske sahip olduklarım hesap ederler. Hastalar meme koruyucu cerrahi yapılmasını, daha hızlı iyileşme ve daha az postoperatif de-formasyon nedeni ile de tercih ederler (1, 8, 34).
Kontrendikasyonlar
Kesin olanlar;
Meme alanının önceden radyasyon alması öyküsü
Gebeliğin ikinci trimestrında tam alan kanser
Farklı kadranlarda iki ya da daha çok primer tümör (multisentrisite)
Negatif cerrahi sınırların sağlanamaması Mamografide diffüz sınırsız kalsifikasyonlarm varlığı
Nispi olanlar
- Meme hacmine göre büyük tümör: Günümüzde Tl ve küçük T2 (tümör çapı 3 cm’den küçük) tümörü olan kadınların çoğunluğu meme koruyucu tedavi için uygundurlar. Literatürde 4-5 cm’den daha büyük tümörlerin tedavisi ile bilgi kısıtlıdır. Meme koruyucu cerrahi erken evre meme karsinomunda (Tl ve T2) uygulanırsa da maksimal tümör çapı kabul edilebilir olmalıdır. Tümör / Meme büyüklüğü oramnı dikkate almak çok daha doğrudur. Kabul edilebilir oranlardaki ipsilateral tümör nüksü nedeni ile hasta seçimi yapılmak kaydıyla büyük tümör çapı, preoperatif kemoterapi ile küçültülerek meme koruyucu tedavi yapılabilir. Günümüzde onkoplastik tekniklerle cerrahi onkolojik prensiplere bağlı kalarak geniş eksizyonlar yapılması mümkün olabilmektedir (8, 33, 35, 36).
- Aynı kadranda çok sayıda büyük tümör ve şüpheli kalsifikasyonlar: Birbirine yakınlığı nedeni ile tek insizyonla negatif cerrahi sınır sağlanarak kozmezisi bozmadan çıkarılabilirlerse bu olgularda meme koruyucu cerrahi yapılabilir.
- Aktif kollajen damar hastalığı: Radyoterapiyi to-lere edememe nedeni ile sorun yaşanır.
Bazı klinik ve patolojik özellikler artık meme koruyucu tedavi için kontrendikasyon kabul edilmemektedirler. Bunlar;
- Tümör lokalizasyonu: Santral lokalize lezyonlar-da, tümör memebaşı-areola kompleksini infiltre ettiyse memebaşı-areola kompleksi de çıkarılarak meme korunabilir. Erken rekonstrüksiyon bu girişimin kabul edilebilirliğini arttırır. Tümörün memebaşı-areola kompleksini infiltre etmediği ancak yakın olduğu santral lezyonlarda ise lezyonla memebaşı tabanı arasında sağlanabilen yeteri kadar temiz alan sayesinde meme başı-areola kompleksi çıkarılmadan meme koruyucu cerrahi yapılabilir. Santral tümörler onkoplastik tekniklere daha çok gereksinim gösteren lezyonlardır (8).
- Mobil aksular lenf nodülü
- Aksular lenf nodülünde mikroskopik tümör
- Aile öyküsü
- Preoperatif kemoterapi: Multisentrik tümörler dışında tek büyük tümörlerin preoperatif kemoterapi ile tümör çaplarının küçültülmesi ve meme koruyucu cerrahi uygulanması düşünülebilir. NSABP B-18 çalışmasında, Tl-3 NO-1 olan 1523 hastaya cerrahi öncesinde veya sonrasında 4 siklus AC verilmiş ve 5 yıllık takipte genel ve hastalıksız sağkalım oranları arasında fark olmadığı ve meme koruyucu cerrahi yapılma oranının arttığı görülmüştür. Yine bir başka çalışmada, büyük ya da lokal ileri meme kanserli 173 hastada başlangıçta mastektomi gerekirken preoperatif kemoterapi sonrası % 25’inde meme koruyucu cerrahi yapılabilmiştir (1, 2, 33).
Cerrahi Teknik
Kozmezisin başarısı cilt insizyonlarınm yeri ve performansına bağlıdır. Langer’s çizgilerini takip eden ve areolaya paralel kurvilineer kesiler en iyi kozmetik sonuçları verir. Saat 3 ve 9 hizasında ya da alt kadranlarda cilt çıkarılmasını da gerektiren lezyonlarda rad-yal insizyon ile iyi sonuç alınabilir. İnsizyon tümörün üzerinde veya ona yakın olmalı ve tümörün tek parça halinde çıkarılmasına izin vermelidir. Ayrıca insizyon, eğer mastektomi gerekirse mastektomi insizyonları içine kolaylıkla girebilmelidir. Önerilen insizyonlar Şekil 2’deki gibidir (2).
Çıkarılan spesmen, oryantasyon materyalleri ile işaretlendikten sonra spesmen grafisi elde edilmelidir. Bu grafi ile mamografide özellikle mikrokalsifikasyonla kendini gösteren duktal karsinoma in situ olgularına ait lezyonun doğrulanması sağlanır. Spesmen grafisi negatif cerrahi sınırı garanti etmez ancak yakın cerrahi sınır varlığında daha fazla doku çıkarılmasına yardımcı olur. (29) İntraoperatif periyodda spesmende rezidüel hastalığı araştırma yöntemleri çeşitlilik gösterir. Bunlar; frozen section, imprint sitoloji, tümör yatağı biyopsisi ya da kavite kenarının tam eksizyonu, spesmenin cerrahi sınırlarının boyanması, tümör spesmeninin makros-kopik değerlendirmesi, intraoperatif ultrasonografi ve spesmen radyografisi şeklindedir. Bu metodlar eğer rezidüel hastalık şüphesi varsa ilave dokuların mümkün olan en az miktarda ve hızlıca çıkarılmasını sağlarlar (37, 38, 39, 40). Literatürde gerek frozen section gerekse imprint sitoloji bu amaçla sıklıkla kullanılırlar. Tablo 6′ daki metaanalizde, frozen section ve imprint sitolojisi ile yapılan intraoperatif patolojik değerlendirmelerin doğruluk, duyarlılık ve özgüllük oranları yer almaktadır (39). Farklı yıllardaki çalışmalarda da görüldüğü gibi her iki metod için de oranlar oldukça yüksek ve birbirine yakındırlar. Çıkarılan spesmenin intraoperatif değerlendirilmesi Şekil 3’deki algoritma göz önüne alınarak yapılabilir (38)
Cerrahi sınır pozitifliğinde reeksizyon yapılmalıdır. Kaç kez reeksizyon yapılabileceği ile ilgili bilgi yoktur. Mastektomi kararı öncesi eksizyon sayısı asla keyfe bağlı olmamalıdır. Bir çalışmada, lumpektomi yapıldıktan sonra cerrahi sınır pozitifliği olan 236 meme kanseri hastasında yapılan reeksizyonlarm sırasıyla; birincisinde % 48, ikincisinde de % 39 oranında cerrahi sınır pozitifliğinin devam ettiği görülmüştür. Yazarlar, reeksizyon gereksinimindeki artışı, hasta yaşının genç olmasına, 2 cm’den büyük tümör çapma, tümörün lobü-ler karsinoma ya da duktal karsinoma in situ ile birlikte olan invazif kanser histolojisine sahip olmasına, yüksek tümör evresine ve birden fazla cerrahi sınır pozitifliğine bağlamışlardır (17). Bu şartlar altında, meme hacminin reeksizyona uygun olup olmadığı, pozitif sınır sayısının çokluğu, cerrahi sınırda var olan tümörün yaygınlığı ve hastanın birden fazla cerrahi girişime izin verip vermediği dikkate alınmalıdır(41, 42). Reeksizyonlarla kozmezisisi bozmadan sonunda negatif sınır elde edile-biliyorsa mastektomiye dönüş için eksizyon sayısı tek başına kontrendikasyon oluşturmaz (43).
Tümörün çıkarıldığı bölgede çok iyi hemostaz sağlanmalıdır. Gelişebilecek hematom uzun süre rezorbe olmaz ve fizik muayenede değerlendirme yapmayı güçleştirebilir. Ancak kavitenin serumla dolması daha iyi kozmezis sağlayacağı için kavite içine dren konulmamalıdır.
Radyoterapi uygulamasının planlanmasını kolaylaştırmak için kavite, klipsler yerleştirilerek işaretlenmelidir.
Kaynaklar
1- Meric-Bemstam F: Breast conservation in breast cancer: surgical and adjuvant consideration. Curr Opin Obstet Gynecol, 2004; 16: 31-36.
2- Morrow M, Haris JR, Destout JM, Monticciolo DL, Strom EA, Vicini FA, Singletary SE, Winchester DP, Schnitt SJ: Pratice guideline for the breast conservation therapy in the management of invasive breast carcinoma. J Am Coll Surg, 2007; 205: 362-376.
3-Veronesi U, Cascinelli N, Mariani L et al Twenty year follow up of a randomized study comparing breast conserving surgery with radical mastectomy for early breast cancer. N Engl J Med, 2002;347: 1227-1232.
4- Fisher B, Anderson S Bryant J et al: Twenty year Mow up randomaized trial comparing total mastectomy lumpectomy and lumpectomy plus irradiation in tire treatment of invasive breast cancer. New Engl J Med, 2002; 347′. 1233-124.
5- Poggi MM, Danfrth DN, Sciuto LC et al: Eighteen year results in treatment of early breast carcinoma with mastectomy versus breast conservation therapy: the National Cancer Institute randomized trial. Cancer, 2003; 98: 697-702.
6- von Dongen JA, Bartelink H, Fentiman IS et al: Long-term results of a randomized trial comparing breast conserving therapy with mastectomy: European Organization for Research And Treatment of Cancer 10801 trial. ] Natl Cancer Inst 2000; 92: 1143-1150.
7- Fovarable and unfavorable effects on long term survival of radiotherapy early breast cancer: an overwiev of the randomized trials Early breast cancer trialists collaborative group. Lancet, 2000; 355:1757-1770.
8-Schwartz GF, Veronesi U, Clough KB, Dixon JM, Fentiman IS, Heywang-Kobrunner SH, Holland R, Hughes KS, Mansel RE, Margolese R, Mendelson EB, Olivotto IA, Palazzo JP, Solin LJ: Consensus conference on breast conservation. J Am Coll Surg, 2006; 107:198-207.
9- Malmstrom R Holmberg L, Anderson H, Mattson J, JSnsson P-E, Tennvall-Nittbv L, Balldin G, Loven L, Svensson J-H, Ingvar C, Moller T, Holmberg E, Wallgern A: Breast conservation, with and without radiotherapy, in women lymph node negative breast cancer: a randomised clinical trial in a population with access to public mammography screening. Eur J Cancer, 2003; 39: 1690-1697.
10- Fisher B, Bryant ], Dignam JJ et al: Tamoxifen, radiation therapy or both for prevention of ipsilateral breast tumor recurrence after lumpectomy in women with invasive breast cancers of one centimeter or less. J Clin Oncol, 2002; 20: 4141-4149.
11-Hugh KS, Schnaper LA, Berry D et al: Lumpectomy plus tamoxifen with or without irradiation in women 70 years of age or older with early breast cancer. N Eng J Med, 2004; 350: 971-977.
12- Fyles AW, McCready DR, Manchul LA et al: Tamoxifen wiyh or without breast irradiation in women 50 years of age or older with early breast cancer. N Eng J Med, 2004; 350: 963-970.
13- Morrow M, Strom EA, Bassett LW, Dershaw DD, Fowble B, Giuliano A, Harsis JR, O’Malley F, Schnitt SJ, Singletary SE, Winchester DP: Standard for conservation therapy in the management of invasive breast carcinoma. CA Cancer J Clin, 2002: 52; 277-300.
14- Hanh CA, Marks LB, Chen DY, Lind PA, Lind HM, Prosnitz LR: Breast conservation rates-barriers between tertiary care and community practice. Int J Radiat Oncol Biol Phys, 2003; 55: 1200-1208.
15- Morrow M, Schmidt R, Hassett C: Patient selection for breast conservation therapy with magnification mammography. Surgery, 1995; 118: 621-626.
16- Pierce LJ, Moughan J, White J, Winchester DP, Owen J, Wilson JF: 1998-1999 patterns of care study process survey of national practice patterns using breast conserving surgery and radiotherapy in the management of stage I-II breast cancer. Int J Radiat Oncol Biol Phys, 2005; 62: 183-192.
17- Cellini C, Huston TL, Martins D, Christos P, Carson J, Kemper S,Simmons RM: Multiple re-excisions versus mastectomy in patients with persistent residual following breast conservation surgery. Am J Surg, 2005; 189: 662-666.
18-Tartter PI, Bleiweiss IJ, Levchenko S: Factors associated with clear biopsy margins and clear reexcision margins in breast cancer specimens from candidates for breast conservation. J Am Coll Surg, 1997; 185: 268-273.
19- Luu HH, Otis CN, Reed WP Jr, Garb JL, Frank JL: The unsatisfactory margin in breast cancer surgery. Am J Surg, 1999; 178: 362-366.
20- Jenkinson AD, Al-Mufti RA,Mohsen Y, Berry Mj, Wells C, Carpenter R: Does intraductal breast cancer spread in a segmental distribution ? An analysis of residual tumour burden following segmental mastectomy using rumour bed biopsies. Eur J Surg Oncol, 2001; 27: 21-25.
21-Mai KT, Yazdi HM, Isotalo PA: Resection margin status in lumpectomy specimens of infiltrating lobular carcinoma. Breast Cancer Res Treat, 2000; 60: 29-33.
22- Cellini C, Hollenbeck ST, Christos P, Martins D, Carson J, Kemper S, LaVigne E, Chan E, Simmons RM: Factors associated with residual breast cancer after re-exicision for close or positive margins. Ann Surg Oncol, 2004; 11: 915-920.
23- Kurtz JM, Jacquemier J, Amalric R, Brandone H, Ayme Y, Hans D, Bressac C, Roth J, Spitalier JM: Risk factors of breast recurrence in premenopausal and postmenopausal patients with ductal cancers treated by conservation therapy. Cancer 1990; 65: 1867-1878.
24- Morrow M, White J, Moughan J, Owen J, Pajack T, Sylvester J, Wilson JF, Winchester D: Factors predicting the use of breast conserving therapy in stage I and II breast cancer. J Clin Oncol, 2001; 19: 2254-2262.
25- Silverstein MJ and Lagios MD: Use of predictors of recurrence to plan therapy for DCIS of the breast. Onclogy, 1997; 11: 393-406.
26- Smitt MC, Nowels K, Carlson RW, Jeffrey SS : Predictors of reexcision findings and recurrence after breast conservation. Int J Radiat Oncol Biol Phys, 2003; 57: 979-985.
27- Winchester DP, Cox JD: Standards for diagnosis and management of invasive breast carcinoma. CA Cancer J Clin, 1998; 48: 83-107.
28- Dillon MF, Hill ADK, Quiim CM, McDermott EW, O’Higgins N: Pathologic assessment of adequate margin status in breast-conserving therapy. Ann Surg Oncol, 2006; 13: 333-339.
29-Singletay SE: Surgical margins in patients with early-stage breast cancer treated with breast conservation therapy. Am J Surg, 2002: 184; 383-393.
30- Vicini FA, Goldstein NS, Pass H et al: Use of pathologic factors to asist in establishing adequacy of excision before radiotherapy in patients treated with breast conserving therapy. Int J Radiat Oncol Biol Phys, 2003: 57; 979-985.
31- Bellon JR, Come SE, Gelman RS et al: Sequencing of chemotherapy and radiation therapy in early stage breast cancer: updated results of a prospective randomized trial. J Clin Oncol: 2005; 23: 1934-1940.
32-Smitt MC and Horst K: Association of clinical and pathologic variables with lumpectomy surgical magrin status after preoperative diagnosis or excisional biopsy of invasive breast cancer. Ann Surg Oncol, 2007; 14:1040-1044.
33- Mcintosh SA, Ogston KN, Payne S, Miller ID, Sarkar TK, Hutcheon AW, Heys SD: Local recurrence in payients with large and locally advanced breast cancer treated with primary chemotherapy. Am J Surg, 2003; 185; 525-531.
34- Waljee JF, Hu ES, Newman LA, Alderman AK: Correlates of patient satisfaction provider trust after breast conserving surgery. Cancer, 2008; 112: 1679-1687.
35- Wolmark N, Wang J, Mamounas E, Bryant J, Fisher B: Preoperative chemotherapy in patients with operable breast cancer: nine-year results from National Surgical Adjuvant Breast and Bowel Project B-18. J Natl Cancer Inst Monogr, 2001; 30: 96-102.
YAZIYI PAYLAŞ


 Lokal ileri meme kanserinde, radyoterapinin rolü ve tedavi alanlarının seçimi
Lokal ileri meme kanserinde, radyoterapinin rolü ve tedavi alanlarının seçimi Lokal ileri meme kanserinde hasta seçimi ve teknik standartlar
Lokal ileri meme kanserinde hasta seçimi ve teknik standartlar Tartışmalı konular; meme koruyucu cerrahi mi, mastektomi + rekonstrüksiyon mu?
Tartışmalı konular; meme koruyucu cerrahi mi, mastektomi + rekonstrüksiyon mu? Metastatik kanserlerde hedefe yönelik tedavi seçenekleri artıyor
Metastatik kanserlerde hedefe yönelik tedavi seçenekleri artıyor Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri
Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri
YORUMUNUZ VAR MI?