Yaşayan Turuva Atı: Bakterilere Gizlenen Virüsler Kanser Tedavisinde Başarılı Oldu
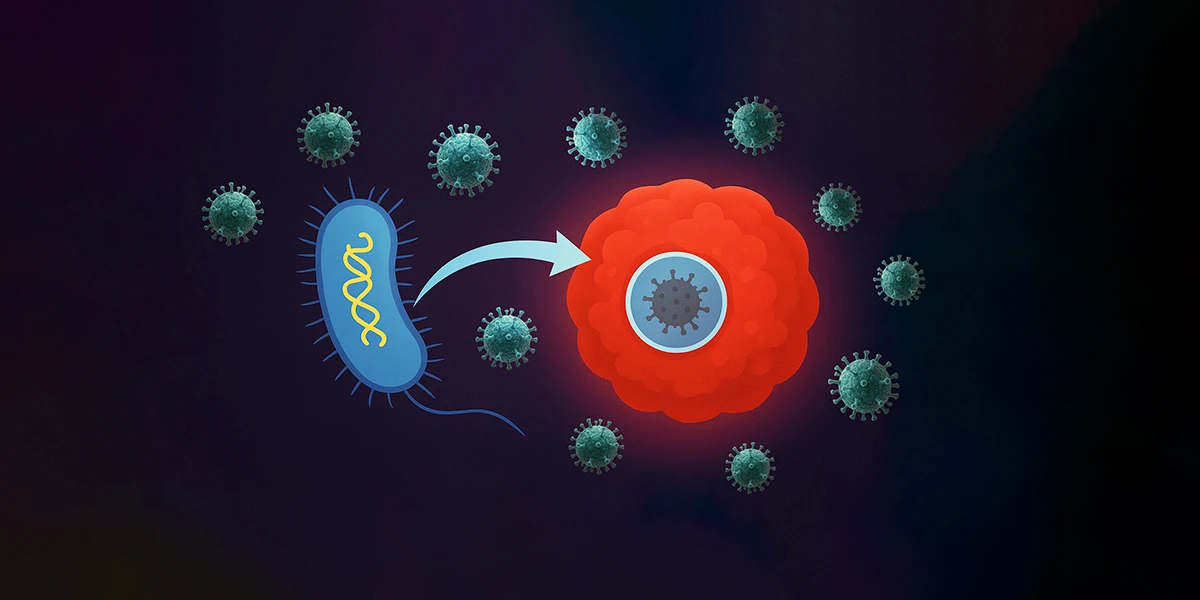
Columbia Üniversitesi’nden araştırmacılar, Salmonella typhimurium bakterilerini kullanarak onkolitik bir virüsü doğrudan tümöre taşıyan ve bağışıklık sisteminden koruyan yenilikçi bir kanser tedavisi geliştirdi. CAPPSID (Prokaryot ve Pikornavirüslerin Koordine Aktivitesiyle Güvenli Hücre İçi Taşıma) adı verilen bu platform, tümöre özgü bakterileri mikroskobik taşıyıcılar gibi kullanarak virüsü bağışıklık savunmasını aşarak katı tümörlerin derinliklerine ulaştırıyor. Bu çığır açıcı yaklaşım, daha güvenli ve hedefe yönelik etkili kanser tedavilerinin ve yeni tümör immünoterapilerin geliştirilmesini sağlayabilir.
Nature Biomedical Engineering dergisinde yayımlanan bu konsept, bu alanda bir ilki temsil ediyor: prokaryotlar (bakteriler) ile virüslerin sentetik olarak tasarlanmış iş birliğiyle, tümöre özgü ve güvenli hücre yıkımı sağlanması.
Yürüttükleri çalışma ile yaşayan calı ilaçlar konusunda önemli bir gelişme sağladıklarını söyleyen çalışmanın eş-yazarı ve sentetik biyolog Zakary Singer, “Bakterileri bir Truva atı gibi programladık; viral RNA’yı tümörün içine taşıyorlar ve ardından kanser hücresinin içinde kendilerini parçalayarak viral genomu serbest bırakıyorlar. Bu genom daha sonra kanser hücreleri arasında yayılarak onları yok ediyor,” dedi.
Genetiği Değiştirilmiş Onkolitik Virüs Tedavisi, Cilt Kanserine Karşı Başarılı Oldu
Mikroorganizmalar Arası Mühendislik İş Birliği
Onkolitik viroterapinin klinik kullanımını uzun süredir zorlaştıran en büyük engellerden biri, bağışıklık sisteminin virüslere karşı hızlı ve güçlü yanıtı. Birçok hastanın, tümöre ulaşmadan virüsü etkisiz hale getiren önceden oluşmuş antikorlara sahip olması, bu tedavi stratejisinin etkinliğini sınırlıyor. Bu sorunu aşmak isteyen Columbia ekibi, biyomedikal mühendisi Dr. Tal Danino liderliğinde ve Rockefeller Üniversitesi’nden virolog Dr. Charles M. Rice iş birliğiyle virüsü bakteri içine gizleyerek bağışıklık sisteminden saklama stratejisi geliştirdi.
Spesifik olarak, tümörlerin düşük oksijenli ve besin açısından zengin mikro ortamlarına doğal eğilim gösteren Salmonella typhimurium suşu, kanser hücrelerini öldürme potansiyeli bilinen bir pikornavirüs olan Senecavirus A’nın RNA genomunu taşımak üzere genetik olarak yeniden programlandı. Bu bakteriler tümör dokusuna ulaştığında kanser hücrelerine girip kendini imha ediyor ve bu esnada viral genomu serbest bırakıyor.
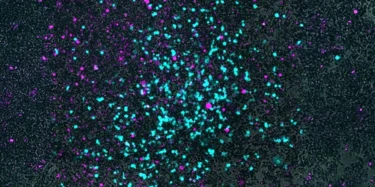
Bu mikroskobik görüntüde gri renk, küçük hücreli akciğer kanseri hücrelerini; magenta (mor-pembe) renk, kanser hücrelerinin içine girmiş Salmonella bakterilerini; cyan renk ise kültürün merkezinden dışa doğru dairesel bir desenle yayılan virüsü göstermektedir. Fotoğraf Kredisi: Danino Lab
Serbest kalan virüslerin yalnızca tümör dokusu içinde yayılarak çoğalabildiğini belirten çalışmanın diğer eş-yazarı ve Columbia Engineering doktora öğrencisi Dr. Jonathan Pabón, şu bilgileri paylaştı: “Amacımız, bakteriyel kanser tedavisini geliştirerek bakterilerin terapötik bir virüsü doğrudan tümör hücrelerine ulaştırmasını ve burada aktif hale getirmesini sağlamaktı. Aynı zamanda virüsün tümör dışına yayılımını sınırlandıracak güvenlik önlemleri de geliştirdik. Bu sistem, daha önce virüslere karşı bağışıklık geliştirmiş hastalarda bile onkolitik virüslerin etkili biçimde kullanılabileceğini gösteriyor.”
Kanser tedavisinde tarihi dönemeç: İlk kez onkolitik bir ilaç FDA’dan onay aldı
Tümöre Özgü Aktivasyon ve Bağışıklık Sisteminden Kaçış Mekanizması
CAPPSID platformunun çığır açıcı özelliği yalnızca virüsleri taşıma yöntemi değil, aynı zamanda kontrollü aktivasyon mekanizmasından geliyor. Virüs, olgunlaşabilmesi için yalnızca genetik olarak modifiye edilmiş bakteriler tarafından üretilen bir bakteriyel proteaza bağımlı olacak şekilde tasarlandı. Bu sentetik bağımlılık, enfektif (bulaşıcı) virüs partiküllerinin sadece bakterilerin bulunduğu bölgelerde—yani tümörün içinde—oluşmasını sağlıyor.
“Bakteriyel mühendislik ile sentetik virolojiyi birleştirerek, tek bir mikroorganizmanın yapabileceğinden çok daha fazlasını başarabilecek çok organizmalı terapilerin yolunu açmayı hedefliyoruz,” diyor Singer. “Bakteriler bir tür görünmezlik pelerini görevi görerek virüsü dolaşımdaki antikorlardan saklıyor ve virüsü hedefe ulaştırıyor.”
Viral RNA’yı bakteriler içine kapsülleyen ekip aynı zamanda dolaşımdaki antiviral antikorlardan da etkili şekilde kaçırmayı başardı. Preklinik fare modellerinde, bu sistem, aktif antiviral bağışıklığa sahip hayvanlarda bile tümör içinde güçlü viral enfeksiyonlar oluşturmayı başardı.
Yaşayan İlaçlar İçin Yeni Nesil Araç Kutusu
Tek başına kullanıldıklarında hem genetiği değiştirilmiş bakteriler hem de onkolitik virüsler bazı sınırlamalara sahiptir: zayıf tümör penetrasyonu, bağışıklık temizlenmesi ve güvenlik sorunları gibi. CAPPSID bu üç soruna da çözüm sunuyor.
Tıp tarihinde yeni bir aşama: FDA, kansere karşı ilk virüs tedavisini onayladı
“Viral partiküller yalnızca bakterilerin yakınında oluşabiliyor, çünkü virüsün olgunlaşması için gereken özel moleküler mekanizma sadece bu bakterilerde bulunuyor. Bu, mikroorganizmalar arasında yapay bir bağımlılık yaratarak virüsün tümör dışına yayılmasını engelleyen ikinci bir güvenlik katmanı oluşturuyor,” diyor Singer.
Araştırmacılar, CAPPSID’in gelecekte farklı tümör türlerine ve tedavi yüklerine (payload) uyarlanabilecek modüler bir araç kutusu olabileceğini belirtiyor. Süregelen çalışmalar; alternatif viral genomların test edilmesi, CAPPSID sisteminin farklı tümör modellerinde değerlendirilmesi ve klinik olarak onaylı bakteriyel suşlarla birlikte kullanımının test edilmesini kapsıyor. Bu yenilikçi yaklaşım, immünoterapinin geleceğinde “yaşayan ilaçlar”ın nasıl şekillenebileceğine dair güçlü ipuçları sunuyor ve onkolojik tedavilerin daha hedefli, güvenli ve etkili hale gelmesine katkı sağlama potansiyeli taşıyor.
Araştırmanın Özeti
Genetik Olarak Mühendisliklenmiş Bakteriler, Onkolitik Bir Virüsü Başlatıyor ve Kontrol Ediyor
Özet: Bakteri ve virüslerin tümör dokuları içinde seçici olarak çoğalabilme yetenekleri, yeni mikrobiyal tedavi yaklaşımlarının sentetik olarak tasarlanmasına öncülük edebilir. Bu çalışmada, Salmonella typhimurium bakterilerinin, Senecavirus A’nın RNA genomunu konak hücre içerisine transkribe edip taşıyarak güçlü bir onkolitik viral enfeksiyon başlatmasını sağlayan iş birliğine dayalı bir strateji tasarladık. Virüs genomu, bakteriler tarafından “kapsüllenmiş” (encapsidated) olarak dolaşımdaki antiviral antikorlardan kaçarak doğrudan tümör dokusuna ulaşabiliyor ve bağışıklık sistemi aktif olan fare modellerinde bile tümör içinde replikasyon ve yayılım başlatabiliyor.
Virüsün olgun enfektif virionlara dönüşebilmesi için bakteriler tarafından taşınan spesifik bir proteaza bağımlı olmasını sağlayacak şekilde virüs genomunu mühendislik olarak tasarladık. Böylece bakterilerin virüs üzerinde doğrudan kontrol sağlayabileceğini göstermiş olduk. Tüm bu sistem, “CAPPSID” (Coordinated Activity of Prokaryote and Picornavirus for Safe Intracellular Delivery – Güvenli Hücre İçi Taşıma İçin Prokaryot ve Pikornavirüsün Koordine Aktivitesi) adı verilen bir platform altında birleştirilmiştir. Bu çalışma, bakteriler aracılığıyla viral genom taşınmasının mümkün olduğunu göstererek bakteriyel tedavi yaklaşımlarını yeni bir boyuta taşımakta ve birden fazla mikrobun iş birliğiyle daha önce mümkün olmayan terapötik hedeflerin başarılabileceğini ortaya koymaktadır.
Kaynaklar ve Referanslar:
1- Bacteria Cloak Viruses to Safely Deliver Cancer-Killing Payloads into Solid Tumors2- Engineered bacteria launch and control an oncolytic virusYAZIYI PAYLAŞ


 Salmonella enfeksiyonları tanı ve tedavisi
Salmonella enfeksiyonları tanı ve tedavisi Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri
Kadınlarda ve erkeklerde en sık görülen kanser türleri ve tedavileri Salmonella nedir? Nasıl bulaşır? Belirtileri ve tedavisi
Salmonella nedir? Nasıl bulaşır? Belirtileri ve tedavisi İmmünoterapi nedir, nasıl uygulanır? Kanser tedavisindeki faydaları
İmmünoterapi nedir, nasıl uygulanır? Kanser tedavisindeki faydaları Çocuk gelişimi ve psikolojisi: Gelişimini etkileyen faktörler
Çocuk gelişimi ve psikolojisi: Gelişimini etkileyen faktörler
YORUMUNUZ VAR MI?